Hoofdstuk 6 Indeling van Stoffen
6.1 Stroomgeleiding
Er zijn miljoenen verschillende stoffen op deze wereld. Deze stoffen kan je onderverdeeld in verschillende stoffen net als in biologie en scheikunde en wiskunde kan je ze onderverdelen in verschillende vakken. Voorwaarden dat een stroom geleiden kan worden:
- Er moeten geladen deeltjes in zitten
- De geladen deeltjes moeten kunnen bewegen
Metalen
Metalen zijn stoffen die alleen bestaat uit metaalatomen. En die deeltjes kan geleiden in de vaste en vloeibare fase.
Zouten
Zouten zijn moleculen die bestaan uit zowel metalen als niet metaal atomen. Ze geleiden deeltjes in de vloeibare fase en als het gemengd is met water.
Moleculaire Stoffen
Moleculaire stoffen bestaan alleen uit niet metaal atomen. Ze geleiden geen deeltjes.
6.2 Metalen
Op macro niveau heeft metalen een paar gemeenschappelijke kenmerken:
- Metalen hebben een glimmend oppervlakte in hun zuivere vorm
- Metalen geleiden elektriciteit en warmte
- Metalen kunnen vervormd worden zeker als ze heet zijn.
- In vloeibare fase kan het mengen met andere metalen.
Er zijn verschillende soort metaal atomen :
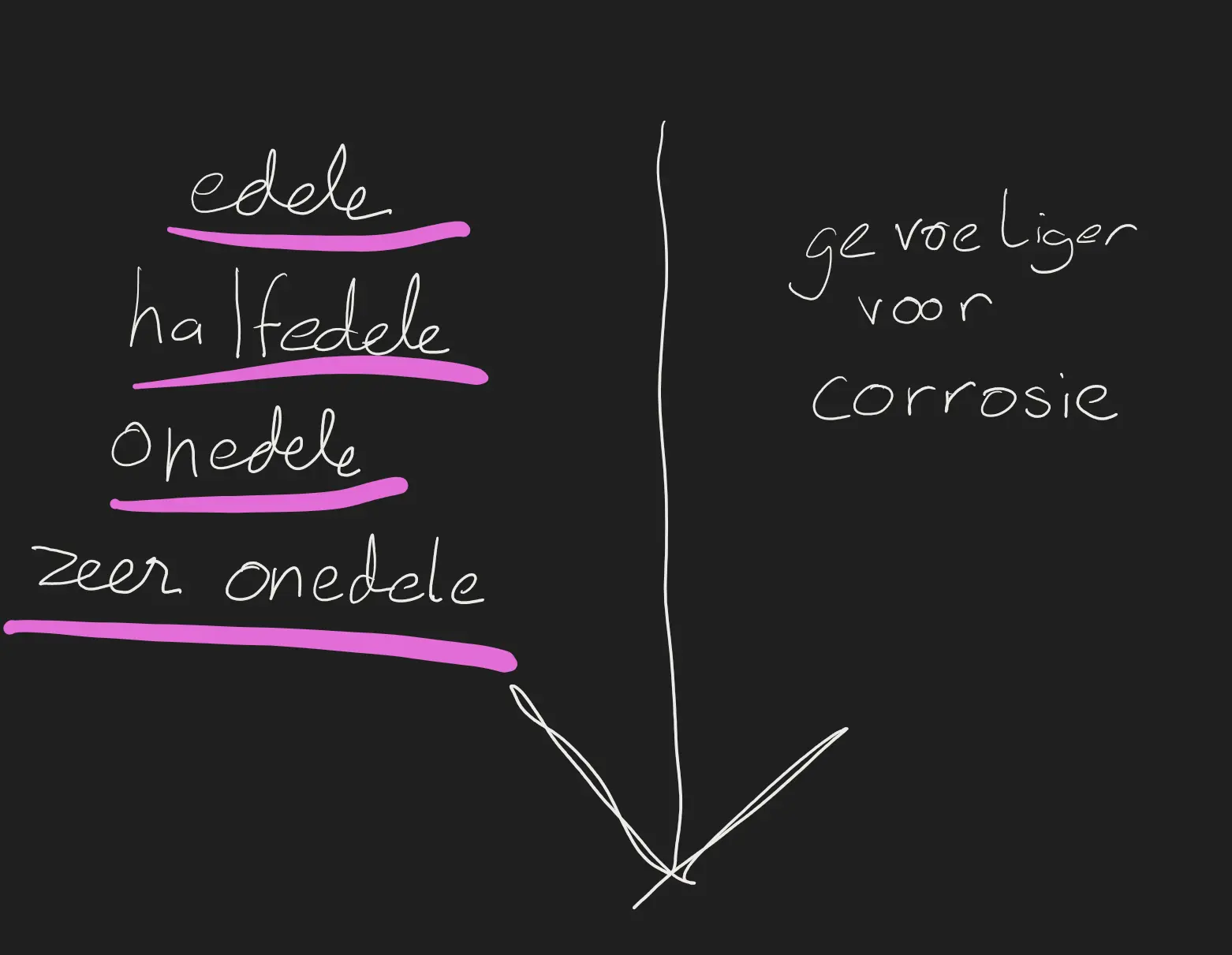 Hoe minder edeel hoe gevoeliger die voor corrosie is. Edele stoffen zoals goud kunnnen in zuivere form gevonden worden in de natuur terwijl onedele stoffen niet zuiver gevonden kan worden in de natuur.
Hoe minder edeel hoe gevoeliger die voor corrosie is. Edele stoffen zoals goud kunnnen in zuivere form gevonden worden in de natuur terwijl onedele stoffen niet zuiver gevonden kan worden in de natuur.
Metalen op microniveau
Metalen op microniveau ziet er net zo uit zoals op de afbeelding hier beneden metaalionen (kan elk metaal zijn uit het periodiek systeem met meer protonen dan elektronen). In een vloeibare of vaste vorm kunnen de elektronen vrij bewegen ook zijn ze aanwezig in een metaal. Dus kan een metaal energie geleiden. De afbeelding hierbeneden is een rooster met metalen en daarom heet het een metaalrooster. Doordat + en - elkaar aantrekken zit er een binding tussen de metaalion en elektron, deze binding noem je een metaalbinding. Een metaal is vervormbaar. Dat gaat makkelijker als je het verwarmt. Maar als waarom is een metaal zo vervormbaar en breekt het niet zoals glas of plastic. Dit kom ook door het metaalrooster. Als je metaal vervormt, verplaats een hele rij met metaalionen. Tijdens het vervormen van metaal is die positieve en negatieve lading nog steeds aanwezig. Deze aantrekkingskracht zorgt er voor dat het metaal niet in brokken uit elkaar valt.
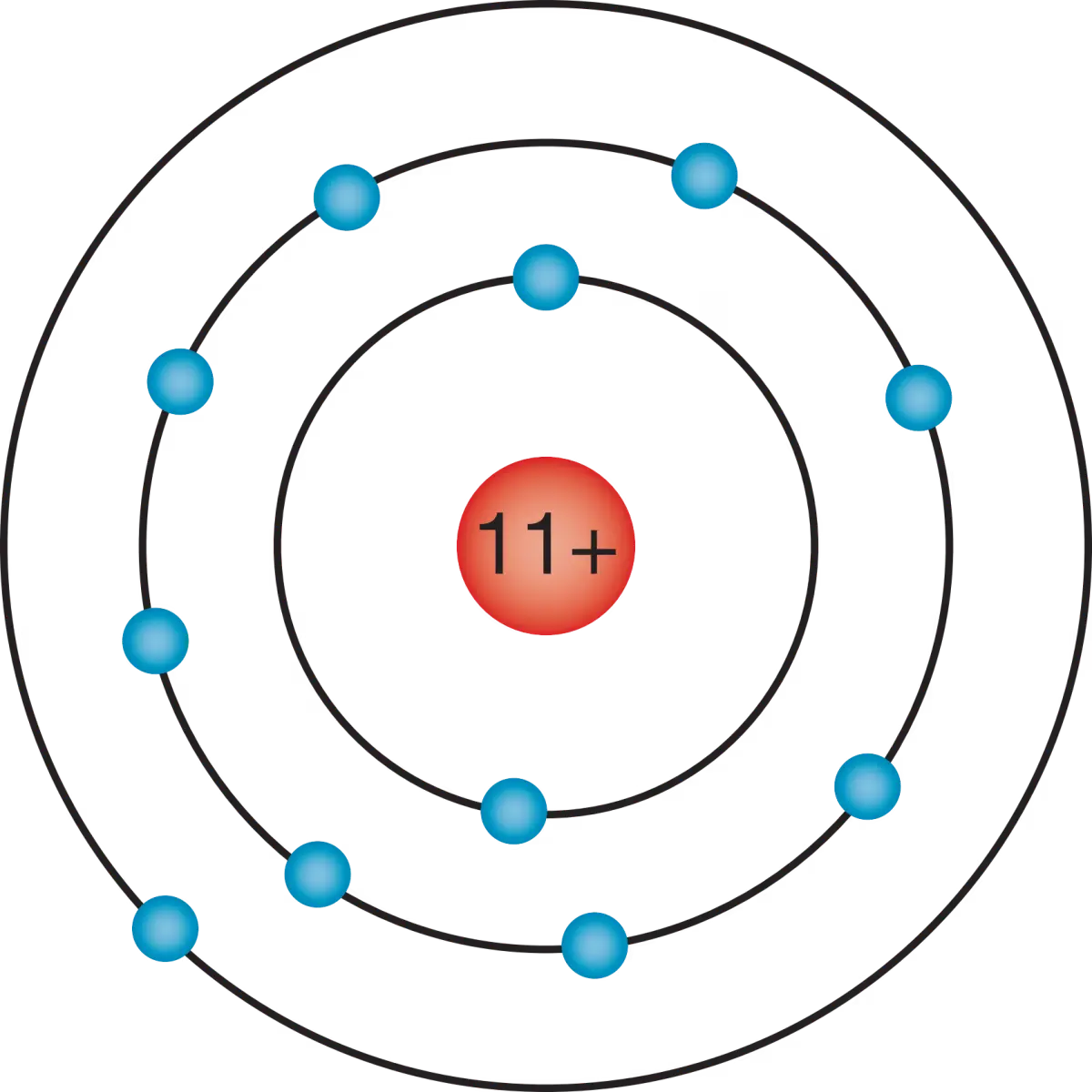
 Het atoommodel van bohr Metaalrooster
Het atoommodel van bohr Metaalrooster
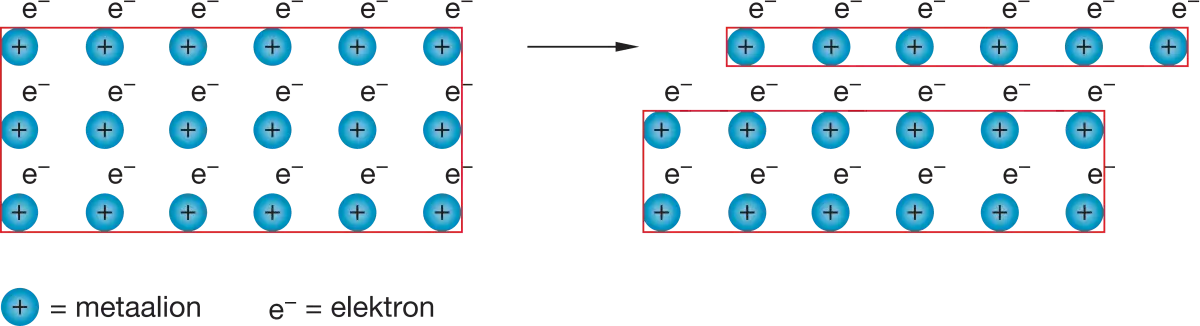 Metaalrooster die vervormt wordt.
Metaalrooster die vervormt wordt.
Legeringen
Als je 2 metalen met elkaar mengt krijg je een legering. Dat is een combinatie van meerdere metalen. Deze zijn harder vervormbaar, dit is verklaarbaar door het metaalrooster. Doordat er kleinere en grotere deeltjes doorelkaar zitten gaat het verschuiven van die rijen moeilijker hierdoor is een legering moeilijker vervormbaar.
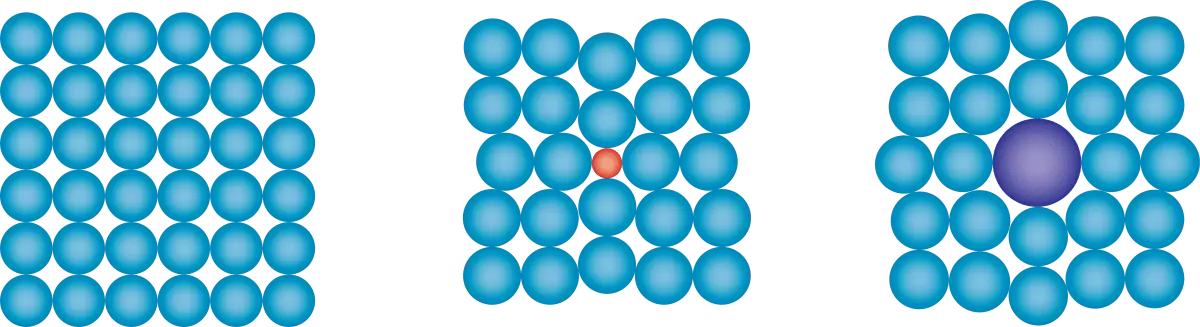 Een metaalrooster met verschillende atomen er door heen.
Een metaalrooster met verschillende atomen er door heen.
6.3 Zouten
Naast keuken zout zijn er veel soorten zout zoals pigmenten (kleurstoffen), kalk, zouten in je water en nog veel meer. Zouten hebben een paar kenmerken:
- Ze hebben een hoog kook en smeltpunt
- Ze geleiden alleen stroom in vloeibare fase en als ze gemengd zijn met water.
Zouten op microniveau
Zouten bestaat uit positieve en negatieve ionen. Ionen zijn atomen waarbij het aantal protonen het aantal elektronen. Je hebt positieve ionen dat is een atoom met meer protonen dan elektronen en een negatief geladen ionen, dat is het tegenovergestelde van positieve ion. In een ionroster heb je positieve metaalionen en negatieve niet-metaalionen. Dit is altijd zo. Bij tafel zout is dit positieve Natrium ionen en negatieve chloor ionen. De ionen omdat ze positief en negatief geladen zijn trekken ze elkaar aan hierdoor hebben ze een hogere smeltpunt en hierdoor kunnen de elektronen niet bewegen in vaste vorm. Maar wel als ze vloeibaar zijn of gemengd is met water. De magnetische veld die er voor zorgt dat de atomen bij elkaar blijven noem je ionbinding.
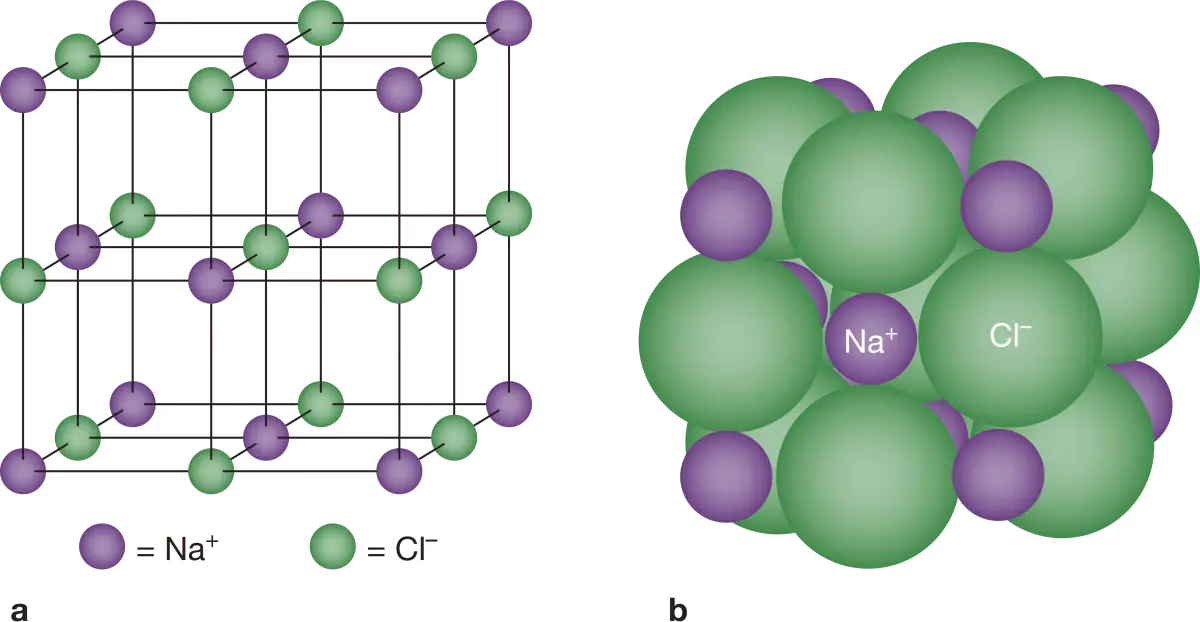
Enkelvoudige en samengestelde ionen
Er bestaan verschillende soorten ionen:
- Enkelvoudige ionen: Ionen die uit een atoomsoort bestaan. Positieve ionen zijn alleen metalen. En negatieve ionen zijn alleen niet metaal atomen.
- Samengestelde ionen: Dat zijn ionen die bestaan uit verschillende atomen (molleculen). Er bestaan zowel positieve als negatieve ionen: Ammoniumion: Carbonaation:
Zouten in water
Als water mengt met zout breekt het de ionbindingen. Waardoor de ionen los van elkaar zitten. Het oplossen van zout in water kun je als een oplossingsverglijking weergeven. Hier is een voorbeeld van een oplossingsverglijking van keukenzout: Nu zit er een extra bij het rijtje s=vast l=vloeibaar g=gas aq=aqua=in water
En als we het glas met water en keukenzout zouden drogen dan krijg je een indampverglijking:
6.4 Moleculaire stoffen
Je kan moleculaire stoffen opdelen in 2 vakken:
- Hydrofiel: Lost op in water
- Hydrofoob: Lost niet op in water
Een hydrofiele stof lost op met andere hydrofiele stoffen. Een hydrofobe stof lost op met een ander hydrofobe stof. Een hydrofobe stof lost op met een hydrofiele stof
Atoombinding en Vanderwaalsverbinding
In bijvoorbeeld een glas water zit het er zo uit: allemaal moleculen. Om de molecuul bij elkaar te houden heb je een atoombinding. En er zit ook een kracht die de moleculen bij elkaar houdt. Dit noem je de vanderwaalsverbinding. De stekte van de vanderwaalsverbinding zorgt voor het kookpunt van de molecuul. 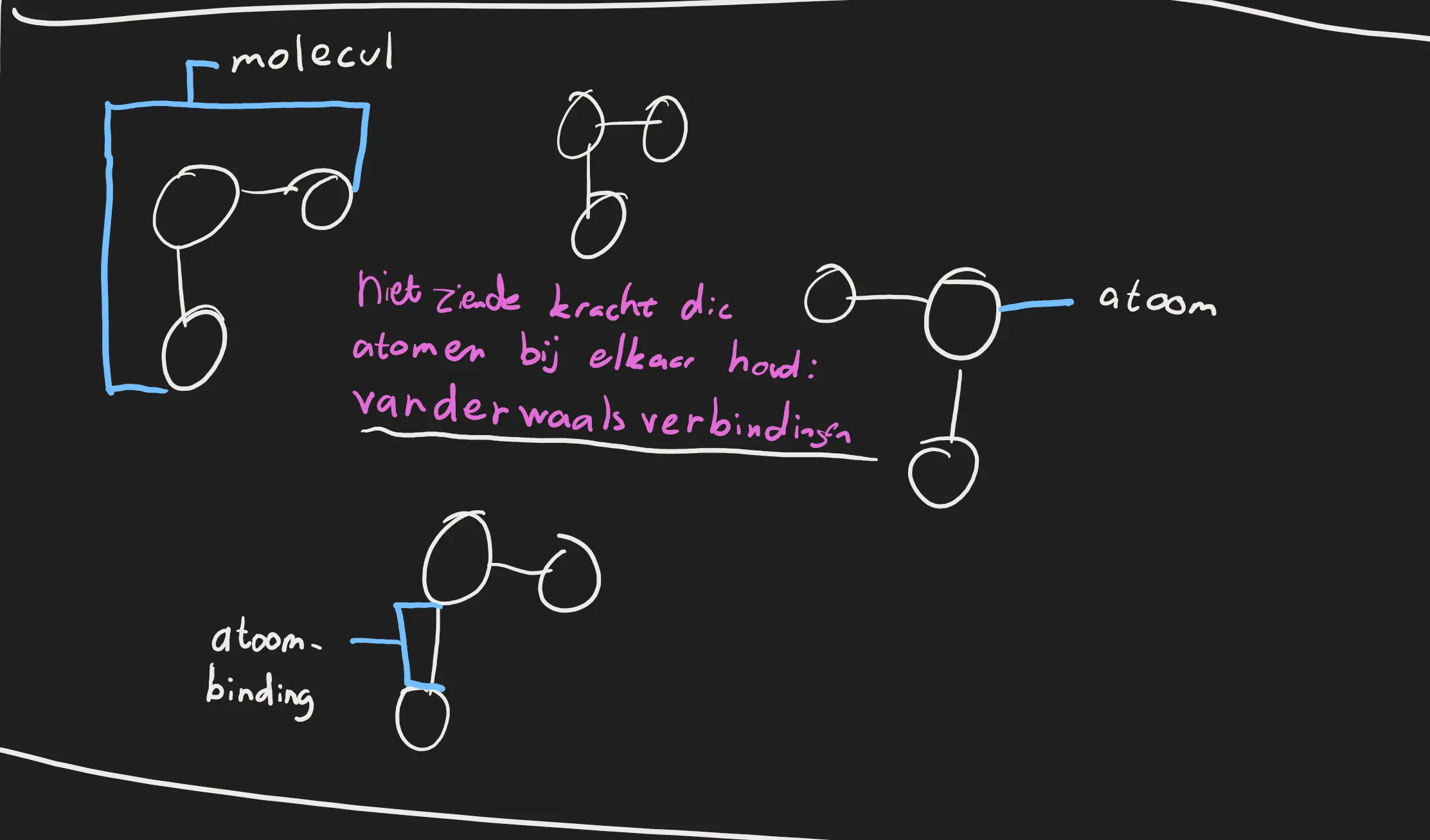 Molecuul rooster
Maar wat bepaald nou de sterkte van de vanderwaalsverbinding? De vanderwaalsverbinding wordt beïnvloed door:
Molecuul rooster
Maar wat bepaald nou de sterkte van de vanderwaalsverbinding? De vanderwaalsverbinding wordt beïnvloed door:
- Hoe hoger de massa hoe sterker de vanderwaalsverbinding
- Hoe groter het contactoppervlakte(als je de molecuul zou opstapelen zou er dan ruimt ontstaan of raakt alles elkaar aan hoe meer de molecuul aanraakt) hoe sterker de vanderwaalsverbinding
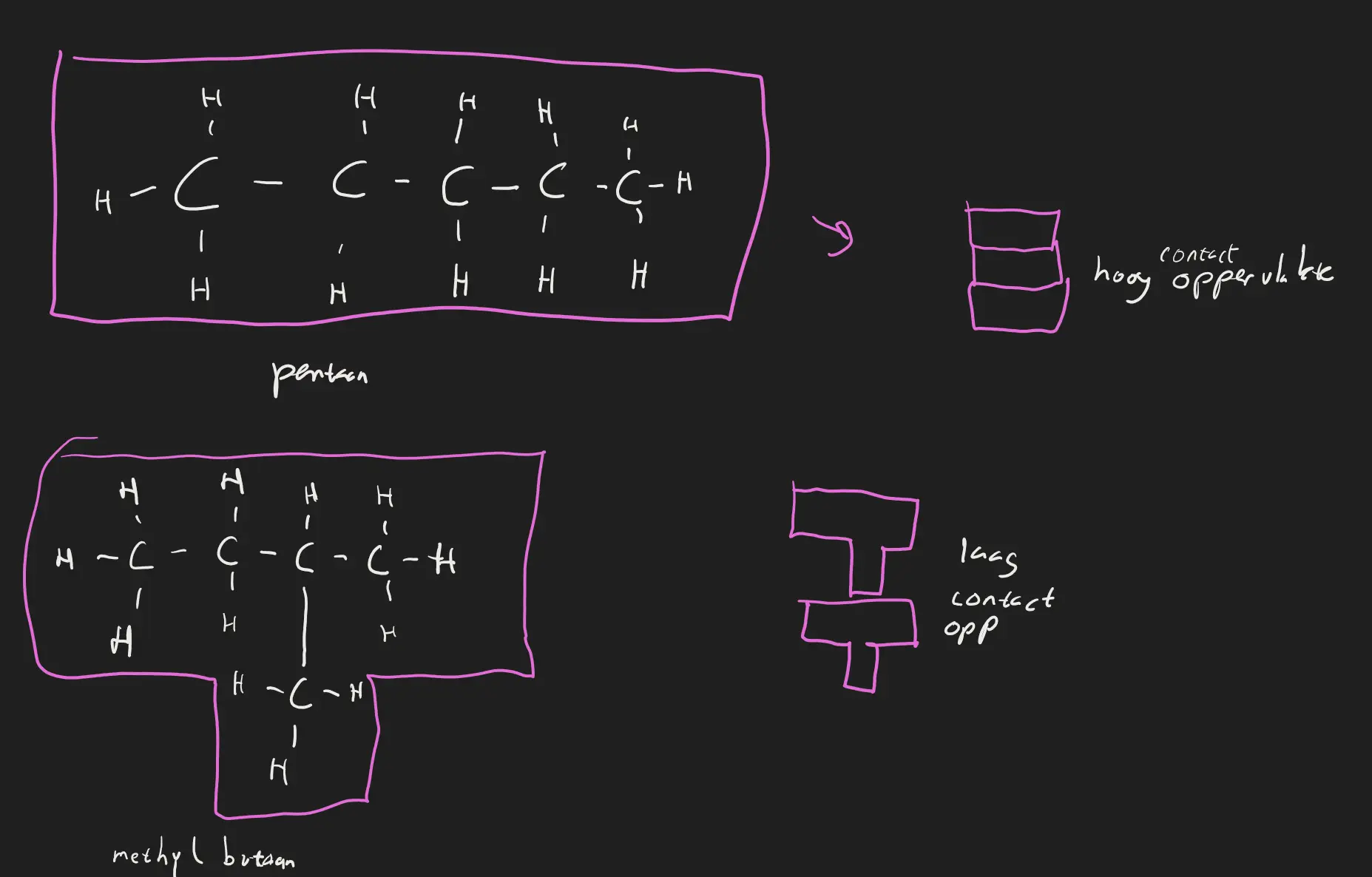 Pentaan en Metyhlbutaan en hun contactoppervlakte
Pentaan en Metyhlbutaan en hun contactoppervlakte
Structuurformule
Je weet dat water is Maar hoe teken je dat? Om dat te weten moet je eerst weten dat we een atoom hebben, die atoom kan maar bepaald aantal verbindingen maken met andere atomen. Dit noem je de covalentie. En om dit te weten kijk je heel simpel op het periodiek systeem.
Stoffen in de 18de rij; de edelgassen kunnen 0 verbinding maken dan de rij links er van maken 1 verbinding. De linker rij daarvan maakt 2 verbindingen helemaal tot de 4de rij van links. En waterstof; H die zit 1 naast rij 18 dus die maakt ook 1 verbinding. Nu we dit weten kunnen we tekenen. Je begint een letter voor mij is dit O en we kijken op het periodiek systeem die maakt 2 verbindingen. En H maakt 1 verbinding en dan kunnen we tekenen. Ik zet een O in het midden en verbind het aan de ene kant met een H en aan de andere kant ook een H. Nu heb je de structuurformule(formule getekent zoals in de afbeelding hieronder) getekend van waterPeriodiek Systeem
Link to original
Het periodiek systeem laat alle atoom soorten zien
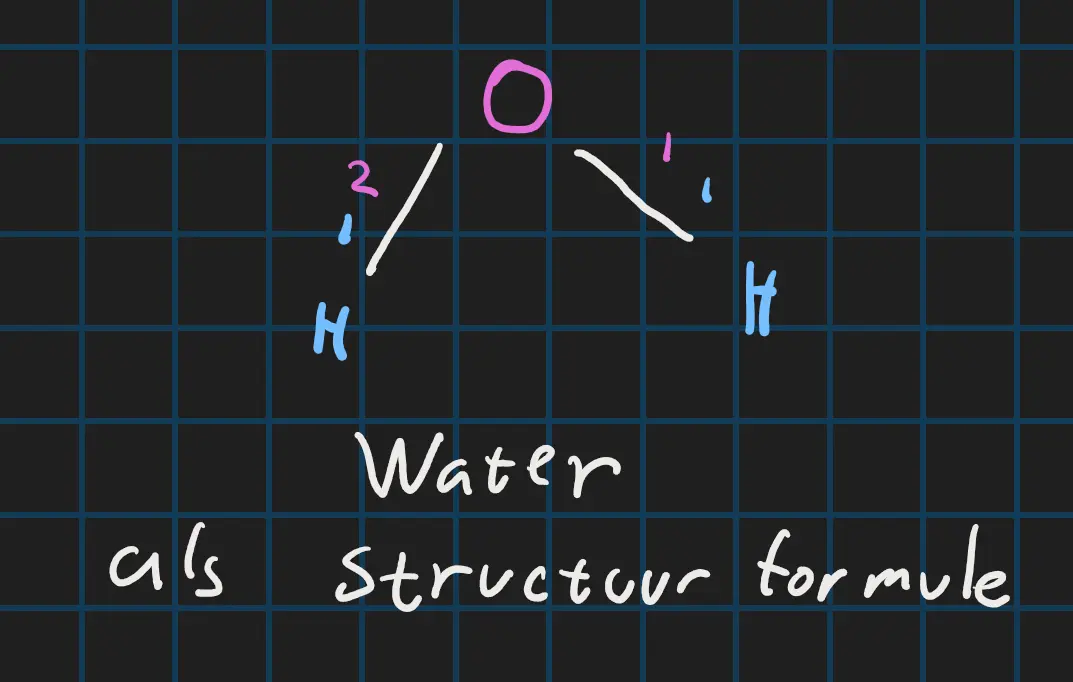 De structuurformule van water
Het is ook mogelijk om als het kan 2 streepjes tussen 2 atomen te teken en zelfs 3.
De structuurformule van water
Het is ook mogelijk om als het kan 2 streepjes tussen 2 atomen te teken en zelfs 3.
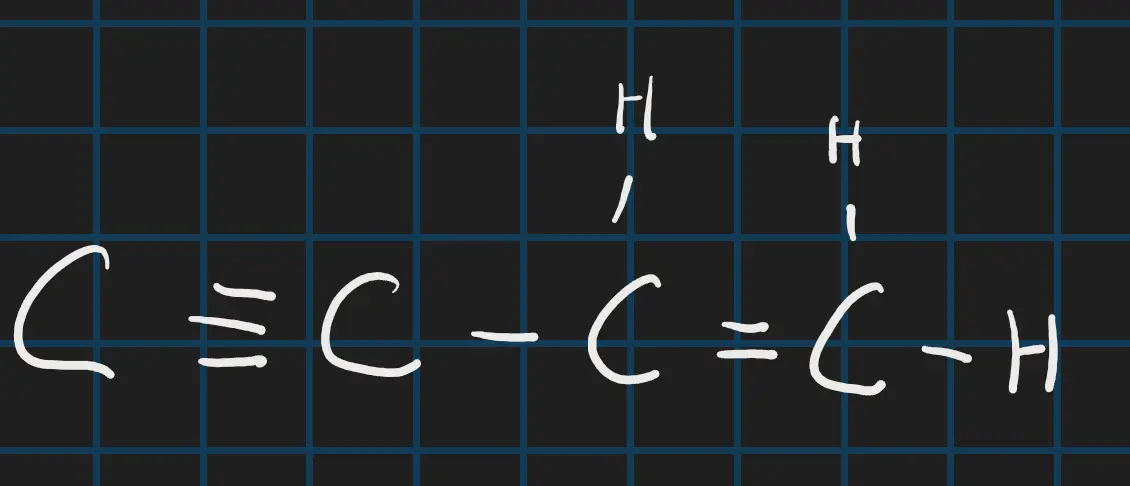 Onverzadigde mollecul (mollecul met meerdere streepjes er tussen)
Let wel op dat je telt zodat iedere atoom precies het aantal covalentie heeft als die nodig heeft anders is het fout.
Onverzadigde mollecul (mollecul met meerdere streepjes er tussen)
Let wel op dat je telt zodat iedere atoom precies het aantal covalentie heeft als die nodig heeft anders is het fout.
H7 Koolstofchemie
Koolstofchemie is de chemie waarbij je stoffen bestudeert noem je koolstofchemie. De belangrijkste bron van koolstofverbindingen (koolstofatomen verbonden met andere atomen) voor de industrie is aardolie. Dat zijn duizenden verschillende stoffen. Het is ontstaan doordat dode planten en dieren met een hele hoge hitte onder druk hebben gestaan. Aardolie wordt uit de rondgepompt, het is een fossiele brandstof en raakt op een dag op. Doordat er geen nieuwe aardolie ontstaat. De moleculen uit aardolie bestaat voornamelijk koolstof en water. Je noemt ze koolwaterstoffen.
Om aardolie goed te kunnen gebruiken moet je het delen in verschillende delen. Omdat elk deel van de grondstof aardolie een andere tempratuur heeft kan je het delen in fracties aan de hand van destilleren. Je noemt dir proces gefractioneerde destillatie. Je verwarmt de aardolie op die veranderd in gas en hij stopt bij elke laag afhankelijk van de type stof. Zie de afbeelding hieronder.
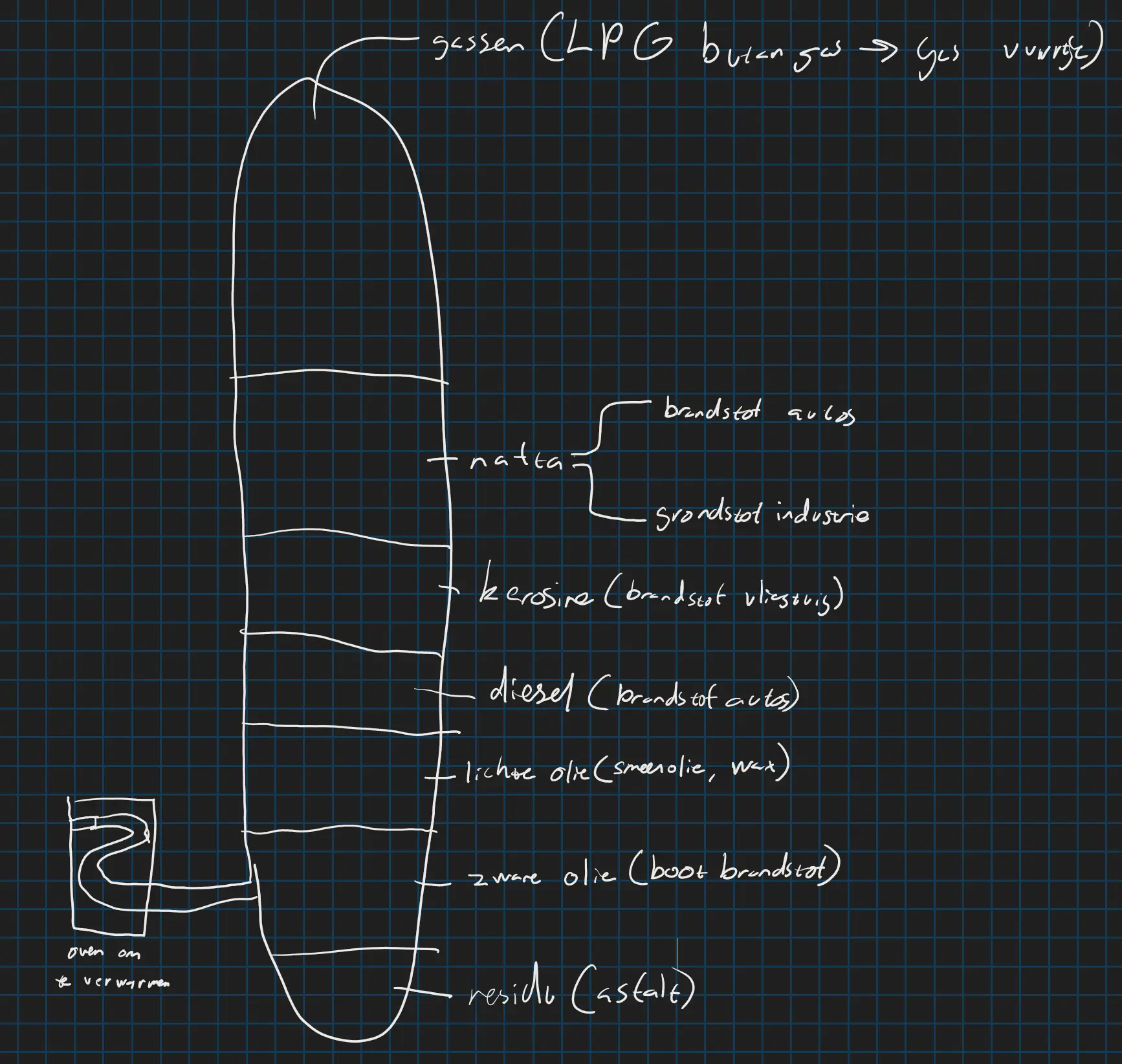 Olieraffinaderij van binnen
Olieraffinaderij van binnen
Alternatieven voor aardolie
Aardolie is slecht voor de natuur als je het aanzet ontstaat er en dat zorgt voor broeikasversterking, als je er meer over wil weten lees het in Aardrijkskunde. Je kan in plaats van aardolie andere koolstofverbindingen gebruiken zoals die in planten zitten. Dit heeft wel een nadeel voor de voedselafdruk, voedselproductie en de natuur. Je kan recyclen, het herbruiken van plastic voor nieuwe plastic of andere koolstofverbindingen.
Koolwaterstoffen verwerken en indelen
Koolwaterstoffen kunnen onvertakt zijn dan gaan ze in een rechte lijn en buigen ze niet af. Of ze zijn onvertakt dan zijn er allemaal vertakkingen in het molecuul.
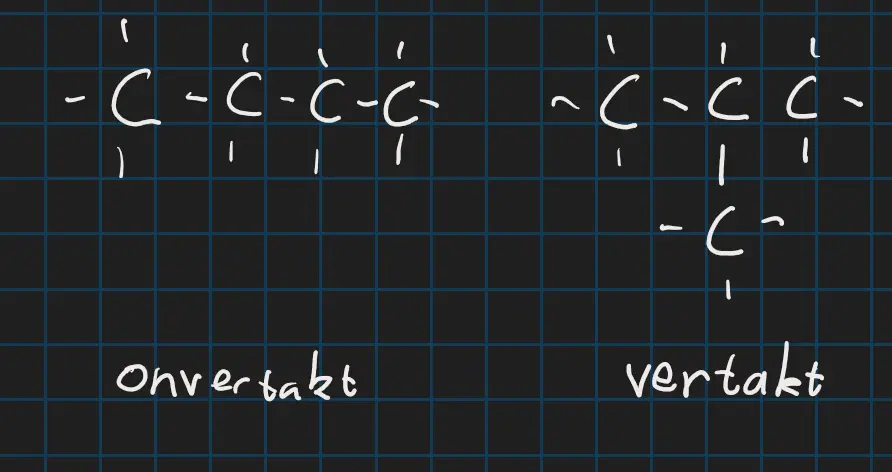
Als je aardoliefracties eenmaal hebt kan je ze natuurlijk verder verwerken door het optewarmen en in aanwezigheid vaan een katalysator start er een ontledingsprocces dit noem je kraken. Hier zie je hoe gekraakt word in en .
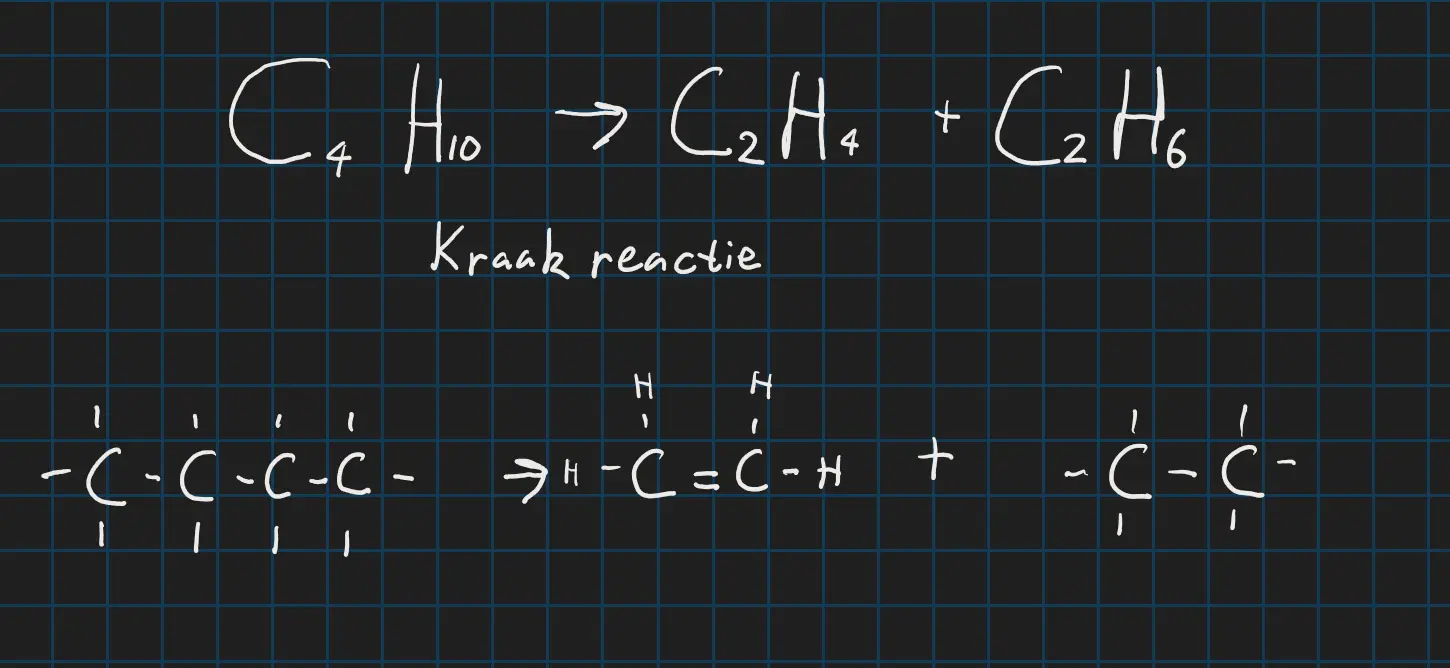 Een kraakreactie getekent
Een kraakreactie getekent
Je ziet dat erdoor een verzadigde en onverzadige verbinding is gekomen in de kraakreactie. Doordat er twee streepjes tussen de koolstofatomen zitten is het een onverzadigde molecuul geworden. En de andere heeft geen dubbele verbinding dus dat noem je een verzadigde verbinding.
7.2 Systematische namen
Een homologe reeks dat is een reeks van moleculen waarbij de verhouding tussen C en H hetzelfde is. Bij alkanen is dat voor elke extra c komen er 2 bij.
Alkanen zijn moleculen waarbij je C atomen hebt en die worden aangevuld met H atomen. Waarbij er alleen enkele bindingen in zitten. De verhouding tussen C en H kan je laten zien in een formule waarbij n het aantal C atomen is:
Naast het tekenen van een structuurformule weten hoe je moleculen schrijft moet je ook nog de:
Systematische Naamgeving kennen. Want je weet dat het molecuul meerdere vormen heeft. En om die precies te weten geef je ze een systematische naam. Dan weet je precies hoe je een bepaalde molecuul moet opschrijven. Om een molecuul een systematische naam te geven zijn er een paar stappen. Die er als volgt uit ziet:
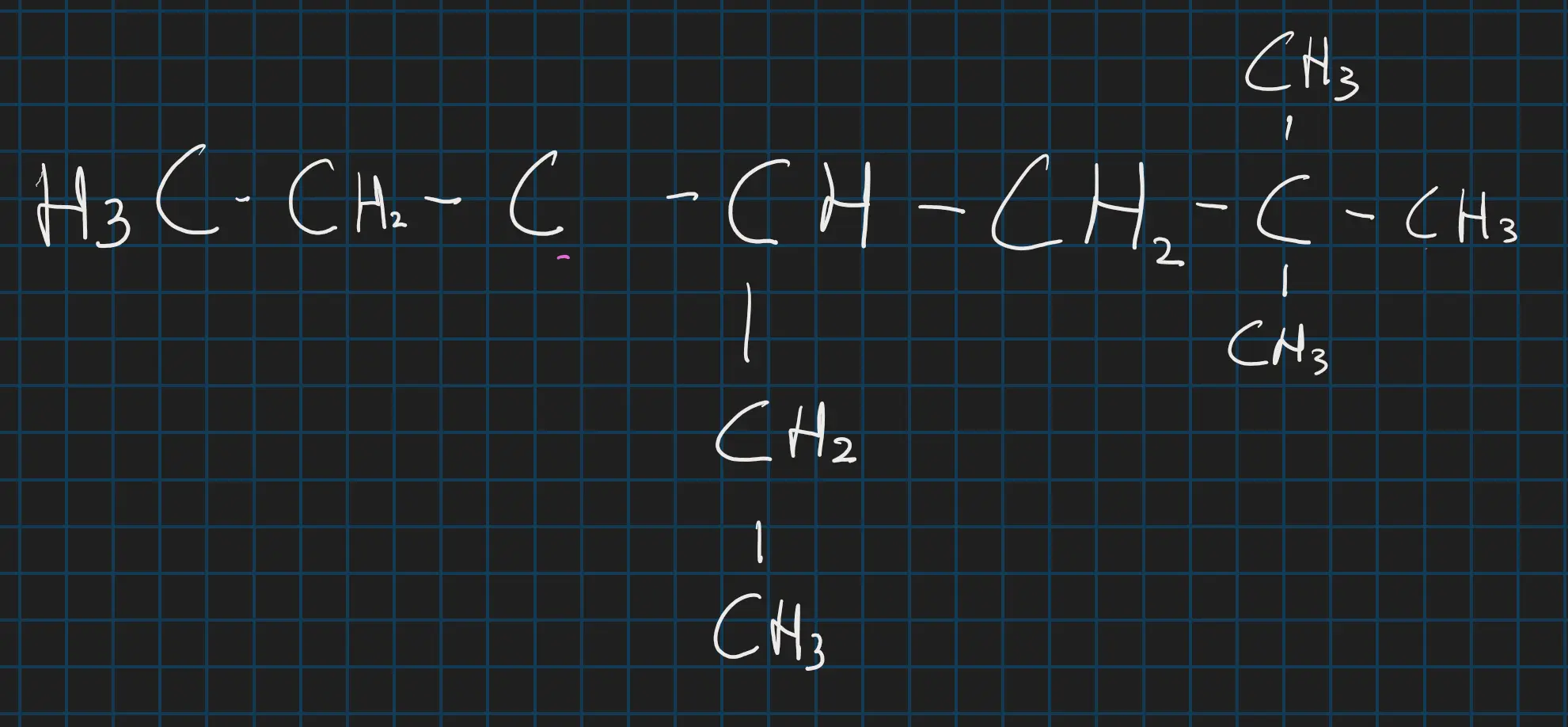 of 4-ethyl-2,2-dimethylheptaan
of 4-ethyl-2,2-dimethylheptaan
- Eerst zoek je de stamnaam dat is de langste onvertakte keten dat is in dit geval 7 koolstofatomen. In het tabel (handig om uit je hoofd te leren) staan de eerste 10 van onvertakte alkanen (zie de tabel hieronder) Hieruit kunnen we zien dat de stamnaam heptaan is.
| Naam | Molecuulformule |
|---|---|
| Methaan | |
| Ethaan | |
| Propaan | |
| Butaan | |
| Pentaan | |
| Hexaan | |
| Heptaan | |
| Octaan | |
| Nonaan | |
| Decaan | |
| Tabel met de eerste tien namen van onvertakte alkanen |
-
Zoek de vertaking op de namen van de twee vertakingen zijn: deze vertaking heet methyl deze vertakiing heet etyhl
We moeten nu eerst de structuurformule numeren waarbij het laagste getal aan de kant zit van de vroegste vertakingen:
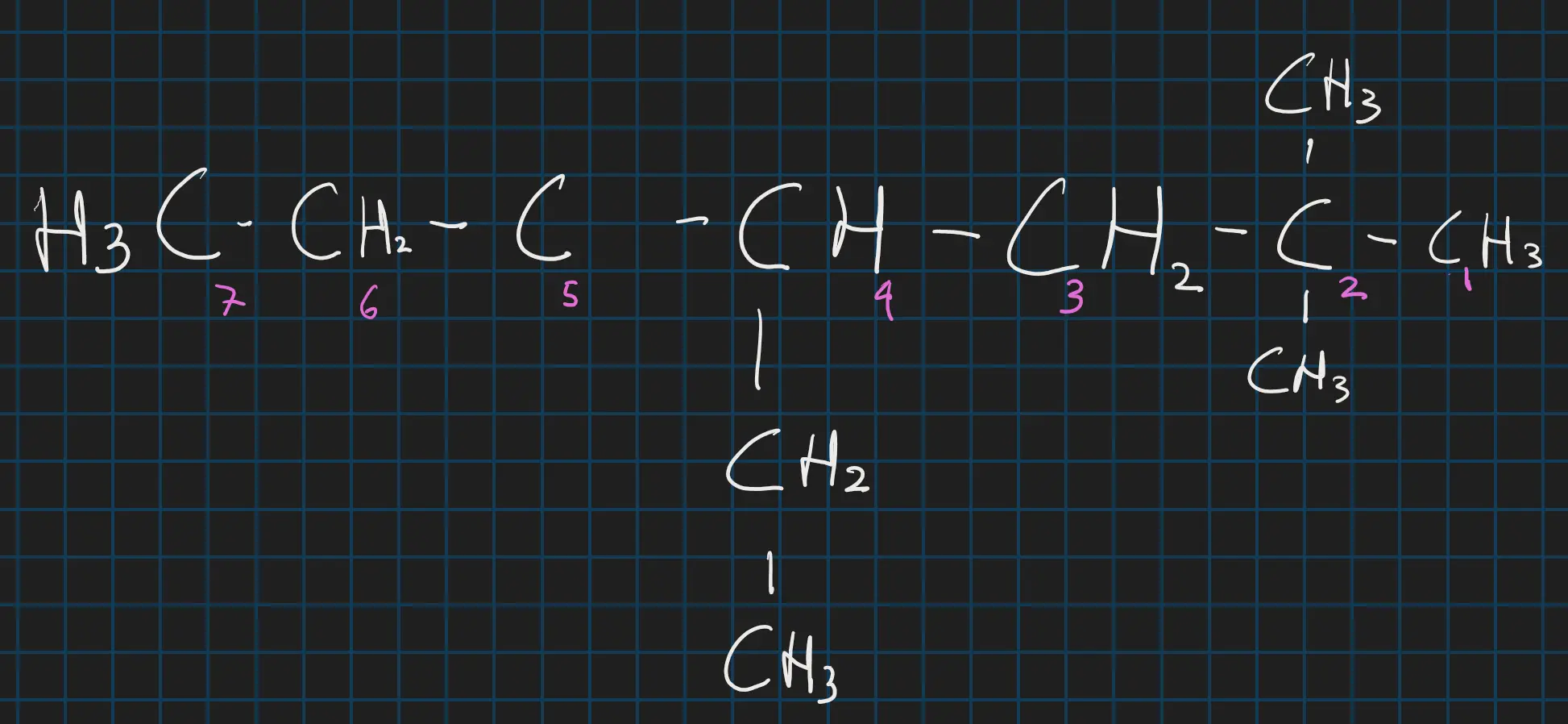 of 4-ethyl-2,2-dimethylheptaan genumerd
Dus we hebben 2 methyl vertakingen op 2 en een ethyl. vertaking op 4:
of 4-ethyl-2,2-dimethylheptaan genumerd
Dus we hebben 2 methyl vertakingen op 2 en een ethyl. vertaking op 4:- 2,2-dimethyl
- 4-(mono)ethyl Je zet eerst de nummer van de vertakingen waar ze plaatsnemen en zegt dan hoeveel er zijn dus is het lijstje hier onder handig om te leren. e komt eerder voor in het alfabet dus komt eerst etyhl. Je zet vertakingen altijd voor de stamnaam en de nummers voor de woorden waarbij je een komma gebruikt om de nummers te scheiden en een - gebruikt tussen een nummer en letter. We hebben nu dan 4-ethyl-2,2-dimethylheptaan je schrijft geen mono op want alleen ethyl betekent al dat er een 1 is. Zo makkelijk is het.
| Nummer | Voorvoegsel |
|---|---|
| 1 | mono- |
| 2 | di- |
| 3 | tri- |
| 4 | tetra- |
| 5 | penta- |
| 6 | hexa- |
Alkenen
Alkenen zijn net als alkanen C atomen verbonden met H atomen maar er gebeurt iets geks. Er komt een dubbele binding Hierdoor is de verhouding tussen C’tjes en H’tjes anders Alkenen hebben ook onvertakte namen het is hetzelfde als bij alkanen alleen zet je er geen -aan achter zoals heptaan maar een achter dus wordt het hepteen.
| Naam | Molecuulformule |
|---|---|
| Metheen | N.v.t. |
| Etheen | |
| Propeen | |
| Buteen | |
| Penteen | |
| Hexeen | |
| Hepteen | |
| Octeen | |
| Noneen | |
| Deceen | |
| Metheen bestaat niet want er kan geen dubbele binding zijn met 1 C. |
Polymeren
Alkenen zijn ontstaan door grotere alkenen te kraken. Deze grote moleculen noem je polymeren, plastic is een voorbeeld van polymeren doordat ze zo lang, zijn zijn ze moeilijk afbreekbaar (in de natuur).
Systematische naamgeving van Alkenen
De systematische naamgeving is bijna hetzelfde als die van Alkanen. Alleen moet je aangeven waar de dubbele binding zit (bij meer dan 4 koolstof atomen) pas wel op dat je dan begint bij nummeren bij het punt dat het dichts bij de dubbele binding zit En moet de stamnaam natuurlijk eindigen met een in plaats van aan. Laten we kijken naar de volgende stof:
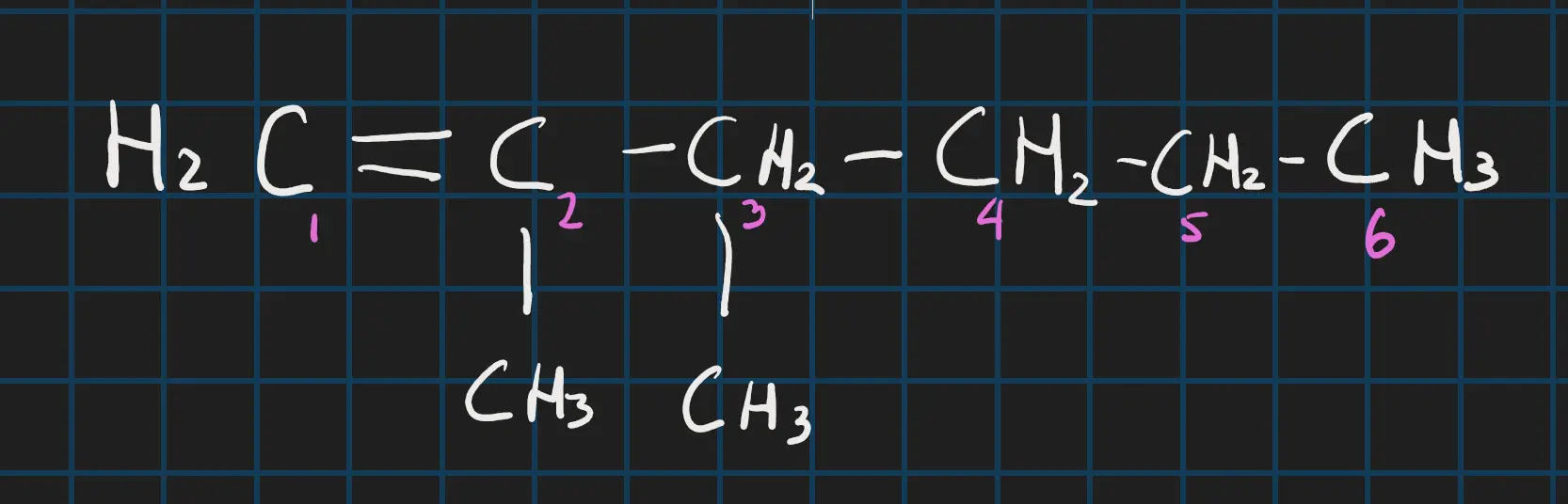
- Stamnaam: Hexeen
- Vertakkingen: 2,3-dimethylhexeen
- Dubbele binding noemen: je moet het nummer hebben van de eerste atoom die de dubbele binding. En deze stom je tussen het nummer en de uitgang van de stamnaam dus: hex-1-een
- Alles bij elkaar zetten: 2,3-dimethylhex-1-een
En nu weet je hoe je moleculen een systematische naam moet geven. Applaus 👏
7.3 Karakteristieke groepen
In koolstofverbindingen (alkaan en alkeen) kunnen andere atoomsoorten voorkomen. Bepaalde atomen geven bepaalde eigenschappen. Atomen die dezelfde eigenschappen geven kun je in een groep stoppen: de karakteristieke groep. Een voorbeeld van een karakteristieke groep zijn bijvoorbeeld de halogeenalkanen. Halogeenalkanen zijn alkanen waarvan de H zijn vervangen door de halogeenatomen (F, Cl, Br, I). De halogeenatomen horen bij de karakteristieke groep want ze zijn kleur en geurloos. Daarom worden ze gebruikt voor dingen die geen geur moeten hebben zoals blusmiddel koelmiddel ect. Veel halogenen zijn schadelijk voor het milieu daarom worden ze steeds minder gebruikt.
Halogeenalkanen hebben ook een systematische naam, dat is gewoon de atoomnaam op alfabetische volgorde: dus als we dan is br=broom. Dat betekent dat het broommethaan is En als het een vertaking is dus 4 C achter elkaar waarbij op de 2de een vertaking voor chloor zet je het als volgt: 2-chloorbuteen.
Systematische naamgeving van alkanolen
Alkanolen zijn moleculen waarbij er een -O-H groepje in zit. Alkanolen = alcoholen. Als er een -OH groepje kan je het systematisch schrijven. Dan moet je aan het einde -ol zetten.
C-C-C | OH
3 C’s = propaan OH = ol Naam = propaanol
Systematische naamgeving van alkaanzuren
Als een groep eindigt op C=O | OH Dat is een dubbele binding met zuurstof en een enkele binding zuurstof en waterstof. Dan is het een zuur en behoort het tot de alkaanzuren. En de systematische naamgeving eindigt dan met -zuur.
Hydrofiel en Hydrofoob op microniveau
Een hydrofiele stof is een stof dat mengt met water want het kan een waterstof of H-brug maken. Deze brug kan alleen ontstaan tussen O..H of H..N. Dit is een andere soort kracht net als een vanderwaalsverbinding. Je weergeeft een H-brug aan met stipeltjes in een structuurformule.
Het kan zijn dat alleen de voorkant H-bruggen maken terwijl de achterkant dat niet doet. Dan heb je een emulsie. Het zorgt er voor dat de kop in water blijft terwijl de staart naar elkaar richten waardoor je belletjes hebt van hydrofobe stoffen maar de buitenkant is hydrofiel. Hierdoor is een emulsie troebel.
THE END
.
